20 jaar onderzoek naar alzheimer
Datum: 19 september 2020
In het populair-wetenschappelijke blad Janus van Amsterdam UMC is dit artikel verschenen over 20 jaar onderzoek naar alzheimer.
Werken aan gezonde hersenen
Minstens een op de vijf Nederlanders krijgt op termijn alzheimer. En daar is geen kruid tegen gewassen. Om de aard van de ziekte te onderzoeken en om te werken aan een remedie, richtte neuroloog Philip Scheltens twintig jaar geleden Alzheimercentrum Amsterdam op. Waar staan we nu?
De ziekte van Alzheimer hangt als een zwaard van Damocles boven ieders hoofd. Om aandacht te vragen voor deze hersenaandoening is op 21 september de jaarlijkse Wereld Alzheimer Dag. In Amsterdam gaat daar de Alzheimer 10-Daagse aan vooraf, georganiseerd door Alzheimercentrum Amsterdam, waar wetenschappelijk onderzoek wordt gedaan naar het ontstaan, de behandeling en preventie van de ziekte.

Philip Scheltens
Hoogleraar Neurologie en directeur Philip Scheltens richtte het alzheimercentrum in december 2000 op. Nu, bij het twintigjarig bestaan, werken er meer dan honderd mensen. Die doen niet alleen onderzoek, er is ook een geheugenpoli waar patiënten worden onderzocht en begeleid.
Scheltens: “Sinds een jaar of drie is alzheimer doodsoorzaak nummer één. Die cijfers komen van het CBS. 270.000 Nederlanders hebben het. Over 25 jaar zijn dat er een half miljoen. Die verdubbeling zie je wereldwijd, onder andere doordat de mensen steeds ouder worden.”
In juli werd het jaarlijkse Wereld Alzheimercongres gehouden, met zo’n 7.000 deelnemers. Online, wel te verstaan: covid-19 dwarsboomde het plan om onderzoekers uit de hele wereld naar Amsterdam te laten komen. Jammer, want persoonlijke ontmoetingen leveren meer inspiratie op; maar het is niet anders, concludeert Scheltens.
Jonge leeftijd
Het onderzoek van Alzheimercentrum Amsterdam richt zich vooral op dementie op jonge leeftijd, ongeveer vanaf vijftig jaar. Scheltens: “Er zijn méér jonge patiënten dan je zou verwachten: tien procent is nog geen 65. De symptomen bij deze patiënten zijn anders dan bij ouderen, en bij zulke jonge mensen wordt het ziektebeeld niet verstoord door andere ongemakken die de ouderdom met zich meebrengt. De ziekte heeft bij hen dus een meer ‘zuivere’ vorm. De kennis daarover is nuttig om het probleem ook bij de oudere groep beter te begrijpen.”
Wanneer alzheimer zich manifesteert, hebben patiënten de ziekte al lang in hun systeem zitten. Naar schatting zo’n twintig jaar. Idealiter zou je het ziekteproces in de hersenen al heel vroeg willen onderkennen. Vroeger kon de aandoening pas ná de dood van de patiënt worden vastgesteld, door diens hersenen te bekijken. In de jaren negentig kwam daar verandering in.
Scheltens promoveerde in 1993 op een methode om alzheimer in de hersenen van levende mensen op te sporen: een MRI-scan. Op de MRI-beelden was de verschrompeling van de hippocampus zichtbaar, een belangrijk aanknopingspunt voor de aanwezigheid van alzheimer. Schade aan de hippocampus kan leiden tot desoriëntatie en verslechtering van het kortetermijngeheugen. De door Scheltens bedachte methode om deze verschrompeling aan te tonen werd wereldwijd gemeengoed.
Data van 7.000 mensen
In 2004 introduceerden Amerikaans/Zweedse onderzoekers de amyloïd-PET-scan. Op deze scans zijn tussen de hersencellen klonteringen te zien van het ‘alzheimereiwit’ amyloïd. Deze methode werd in VUmc Alzheimercentrum (tegenwoordig Alzheimercentrum Amsterdam, Amsterdam UMC) verder ontwikkeld. Inmiddels wordt gewerkt aan meerdere diagnostische middelen, zoals onderzoek van bloed en hersenvocht van de patiënt. Het is cruciaal om de ziekte op deze manier te kunnen diagnosticeren: daarin ligt niet alleen de sleutel voor de kennis over alzheimer besloten, maar mogelijk ook die voor preventie (zie hieronder), behandeling en hopelijk zelfs voor genezing.
Het stellen van een diagnose verloopt bij iedereen die binnenkomt bij de geheugenpoli via dezelfde route, vertelt hoofd klinisch onderzoek Wiesje van der Flier: “Patiënten worden gezien door een neuroloog en een gespecialiseerd verpleegkundige. Dan door een neuropsycholoog; die onderzoekt hun geheugen, ruimtelijk inzicht en taalvermogen. Er wordt bloed en hersenvocht afgenomen. En er wordt een MRI-scan gemaakt van de hersenen.
“In bloed en hersenvocht zoeken we biomarkers, meetbare indicatoren, voor alzheimer. Hersenvocht is de vloeistof waarin de hersenen liggen. Met behulp van een ruggenprik kun je daarvan iets afnemen. De stoffen die in dat hersenvocht ronddwarrelen, vormen een afspiegeling van wat er in de hersenen gebeurt.” Zo wil het alzheimercentrum niet alleen patiënten helpen, het vergaart meteen informatie en kennis.
Scheltens: “Met toestemming van de patiënten slaan we de verzamelde gegevens op in een databank: het Amsterdam Dementia Cohort. Na 20 jaar zitten daarin de gegevens van 7.000 mensen. Het is een van grootste dementie-dataverzamelingen ter wereld.”
Schade in hersenen afbeelden
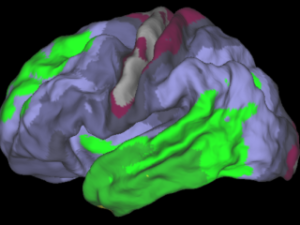
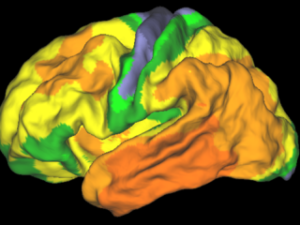
Een andere biomarker voor alzheimer is het tau-eiwit. Neurowetenschapper Rik Ossenkoppele werkt aan een methode om stapelingen van dat tau-eiwit aan te tonen: “Amyloïd-stapelingen zitten tússen de hersencellen, maar tau zit ín de hersencellen. Die cellen hebben een moeilijk doordringbare beschermlaag. Daarom visualiseren we het tau-eiwit met behulp van PET-scans. Een PET-scan meet de functie van de hersenen door het injecteren van een licht radioactief stofje, dat via de bloedbanen naar de hersenen gaat. Dat stofje kan door die beschermende laag rond de hersencel heen, en bindt zich daar aan de tau-eiwitten. Zo kun je de aanwezigheid ervan aantonen.”
Een PET-scan levert een doorsnee van de hersenen op waarop je kunt zien waar en hoeveel tau-eiwit aanwezig is, legt Ossenkoppele uit. “Als je deze onderzoeken periodiek herhaalt, zie je die eiwitten in de loop der tijd vermeerderen. Het tau-eiwit verspreidt zich van cel tot cel. Het unieke aan een PET-scan is dat je de alzheimerschade in de hersenen af kunt beelden. We weten inmiddels dat tau sterk samenhangt met de ernst van de klachten van de patiënt. Er zijn echter grote verschillen tussen patiënten. Waarom ontwikkelt de ziekte zich bij de ene persoon snel en agressief en is het beloop bij een ander relatief mild?
|
|
“In de toekomst wordt dit een diagnostisch middel waarvoor je patiënten selecteert: bij twijfel over de juiste diagnose krijgen ze een PET-scan. Je wéét dat er een ziekte is, maar je wilt meer zekerheid of het alzheimer is of een andere vorm van dementie.”
De tau-PET-scan kan vooralsnog niet in de praktijk ingezet worden voor diagnostiek bij alzheimerpatiënten. “Hij is pas in 2013 voor het eerst beschreven. Totdat er toestemming komt van de European Medicines Agency voor klinisch gebruik, wordt deze techniek vooral ingezet voor wetenschappelijk onderzoek, om de ontwikkeling van de ziekte beter te begrijpen.”
Kans op dementie berekenen
Wiesje van der Flier kreeg in 2019 een bijzondere onderscheiding – een Parel – van ZonMw, de organisatie voor gezondheidsonderzoek en zorginnovatie. Zij ontving de onderscheiding voor de innovatieve rekenmodellen die zij ontwikkelde samen met haar team (ABIDE-studie). Daarin combineert ze persoonlijke kenmerken van de patiënt en biomarkergegevens. Uit de berekeningen rolt een voorspelling over het individuele risico op dementie.
Van der Flier: “Mensen bij wie wij een milde cognitieve stoornis constateren, hebben een kans binnen drie jaar een vorm van dementie te ontwikkelen. Die krijgen nu te horen dat ze vijftig procent kans hebben op deze hersenziekte. Ik vind dat een rot-uitspraak: wat moet je daar als patiënt nou mee? Vijftig procent is veel, maar je hebt dus ook vijftig procent kans het níet te krijgen.”
“ABIDE wil verder gaan”, vertelt Van der Flier. “Wij willen het risico op het ontwikkelen van dementie preciezer uitrekenen: is dat hoog of laag? Het kan zomaar zijn dat je hooguit twintig procent kans hebt: dat is een hele geruststelling.”
“Naast het rekenmodel hebben we een zogeheten gespreksstarter ontwikkeld om dokters te helpen het gesprek aan te gaan over uitslagen van diagnostische tests: wilt u de uitslag wel of niet weten? Dat moet je vooraf bespreken met de patiënt. Wat zijn de mogelijkheden? Wat zijn de voordelen? Wat zijn de nadelen?”
Vaccin
Zowel Scheltens als Van der Flier hameren erop dat er veel meer onderzoek nodig is naar de ziekte die zo velen zal treffen. Daarvoor is geld nodig, en meer deelnemers voor de onderzoeken. Van der Flier doet een oproep: “Via hersenonderzoek.nl kunnen mensen zichzelf opgeven, of familieleden bij wie een vermoeden is van alzheimer. Het is belangrijk dat er voor specifieke onderzoeken proefpersonen bij komen.”
Alzheimer is weliswaar nog niet te genezen, maar wel te behandelen, benadrukken de onderzoekers. Eén pil tegen alzheimer komt er nooit, zegt Scheltens, er wordt gezocht naar een combinatie van middelen. “Een ‘cocktail’ van medicijnen. Daarin zitten middelen tegen amyloïd- en tau-eiwitten. En een ontstekingsremmer. En iets om de prikkeloverdracht in de hersenen te optimaliseren.”
Daarnaast wordt wereldwijd gewerkt aan een vaccin.
Scheltens: “Bij alzheimer vormen twee eiwitten abnormale stapelingen in de hersenen. Met een vaccin probeer je de stapeling te remmen of te voorkomen, doordat mensen zelf antistoffen ontwikkelen tegen die schadelijke eiwitten.”
“Het uiteindelijke doel van elke behandeling waarnaar wij helpen zoeken, is dat je de ziekte zo vroeg mogelijk detecteert en hem dan probeert te stoppen.”
Tweelingen geven het antwoord
Zit alzheimer in de genen of is de ziekte een gevolg van leefstijl? Neurowetenschapper Anouk den Braber legt uit.
Of een ziekte een sterke erfelijke component heeft, laat zich het beste onderzoeken door eeneiige tweelingen te volgen. Hun genoom komt honderd procent overeen. Wanneer de een wel ziek wordt en de ander niet, moet de oorzaak voor die ziekte worden gezocht in verschillen in hun omgevingsfactoren of leefstijl.
Anouk den Braber werkt aan het langdurige tweelingonderzoek naar alzheimer dat sinds 2014 loopt. Daarin zijn 99 – cognitief gezonde – oudere tweelingparen opgenomen. Den Braber: “Bij de start kregen ze vragenlijsten over hun leefstijl, en we namen bloed en hersenvocht af. Ook maakten we een MRI- en een PET-scan. In 2017 hebben we ze teruggevraagd: is er in die tussentijd iets veranderd?” Inmiddels is het onderzoek aan zijn derde ronde toe: zo wordt het mogelijk de eventuele invloed van de omgeving te volgen op de ontwikkeling van alzheimer.
Den Braber: “Hoewel de tweelingen genetisch identiek zijn, zagen we wel verschillen in de hoeveelheid stapeling van het ‘alzheimer-eiwit’ amyloïd in de hersenen. Bij achttien paren had de één deze stapeling wel en de ander niet. De grote vraag is: heeft degene die de stapeling wél heeft iets speciaals meegemaakt, en wat dan? Of heeft degene die het níét heeft een beschermingsfactor in zijn systeem? En waardoor is die persoon dan beschermd? Misschien krijgt iemand geneesmiddelen tegen hart- en vaatziekten om de bloeddruk te beheersen? Of doet hij aan sport? Of misschien zijn er verschillen in het tempo van stapeling: krijgt de ander het op termijn ook?”
“De groep is te klein om te zeggen welke omgevingsfactoren precies verantwoordelijk zijn voor het verschil”, stelt Den Braber. “Maar ons onderzoek wijst wel uit dat omgeving een belangrijke rol speelt bij het begin van de ziekte.”
Aanpakken die leefstijl!
Kunnen we hersengezondheid verbeteren met behulp van leefstijlinterventies? Neuropsycholoog Sietske Sikkes geeft toelichting.
“Het krijgen van alzheimer is een kwestie van enorme pech hebben”, zegt Sietske Sikkes, neuropsycholoog en epidemioloog. Maar wat zou het fijn zijn als het lukte die pech de pas af te snijden. Sikkes en haar team onderzoeken bij het alzheimercentrum onder andere de mogelijkheid alzheimer te voorkómen, en het verband tussen de ziekte en leefstijl. “Er zijn rekenmodellen die schatten dat een derde van het vóórkomen van alzheimer is terug te voeren op leefstijl. Risicofactoren zijn bijvoorbeeld weinig beweging, lage opleiding, roken, depressie, diabetes, hoge bloeddruk, obesitas. Wanneer we deze risico’s verkleinen, zou dat grote maatschappelijke impact kunnen hebben.”
Wat verstaan we onder een leefstijl die goed is voor de hersengezondheid? We kijken hiervoor naar plaatsen op de wereld waar relatief veel mensen gezond ouder worden dan negentig. Zoals de eilanden Okinawa in Japan en Sardinië in Italië. Deze negentigplussers onderscheiden zich door een voedingspatroon met veel groenten, fruit en vis; veel beweging door groenten zelf te verbouwen; en een intensief sociaal leven door met iedereen een praatje te maken.
In die richting moeten we denken als we in Nederland streven naar een leefstijl die de kans op alzheimer zou kunnen verkleinen. Uit onderzoek van Sikkes’ promovendus Linda Wesselman blijkt dat mensen met lichte geheugenklachten grote behoefte hebben aan wetenschappelijk onderbouwde informatie over leefstijl en hersengezondheid. Daarom hebben Sikkes en Wesselman aan deze website een handzame tool toegevoegd met praktische tips zoals: kom in beweging; blijf sociaal actief; daag uw hersenen uit; verminder stress; denk positief. En eet gezond, natuurlijk. Toekomstig onderzoek richt zich op het verder uitwerken van een gepersonaliseerde leefstijl-tool om zo de kans op alzheimer te verkleinen. Lees hier tips voor een leefstijl die de hersenen een oppepper geven.
Steun onze strijd tegen dementie
Genezen kunnen we de ziekte van Alzheimer en andere ziektes die dementie veroorzaken dus nog niet, maar we werken keihard aan onderzoek naar behandelmethodes. Uw hulp is hard nodig en wij zijn u zeer dankbaar voor uw steun. Alle giften komen ten goede aan het onderzoek. Doneer nu!
Tekst: Mieke Zijlmans
Foto bovenaan: Bas Losekoot